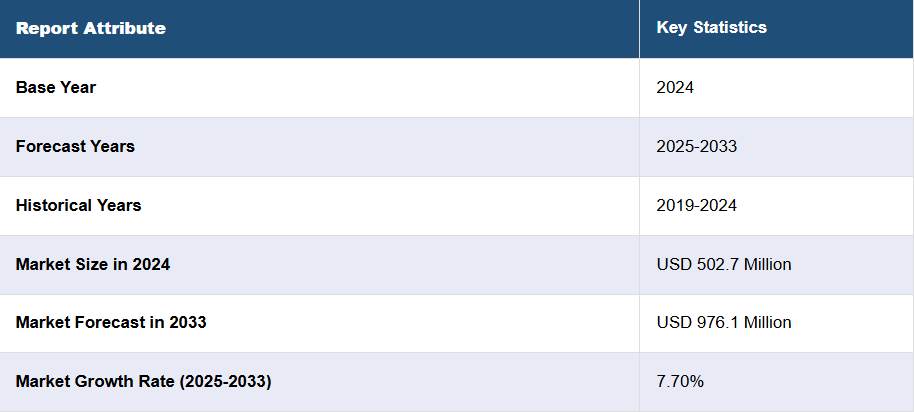
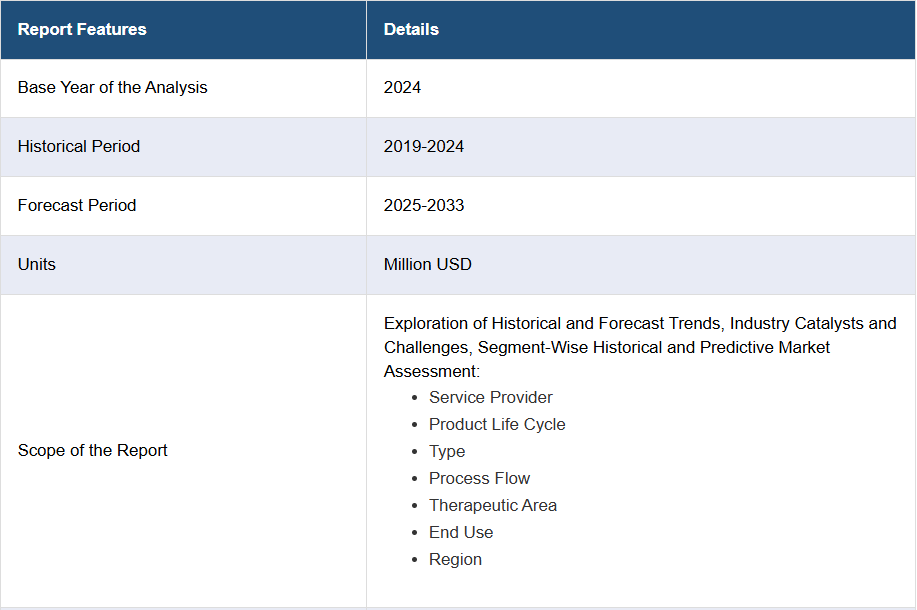
日本の医薬品安全性監視市場の動向:
日本の医薬品安全性監視市場は、主にいくつかの相互に関連する要因により、力強い成長を続けています。まず、地域における医療サービスの需要の高まりにより、医薬品の消費量が増加し、医薬品の安全性を注意深く監視する必要性が高まっています。さらに、慢性疾患の有病率の増加や、新しく複雑な治療法の導入も、医薬品安全性監視市場の拡大を後押ししています。さらに、日本の規制当局は医薬品の安全性に関する監督を強化し、製薬会社に厳しい報告要件を課しています。これにより、医薬品安全性監視業務を専門サービスプロバイダーに委託する必要が生じ、市場の成長が促進されています。同時に、医療従事者や患者が有害事象の報告の重要性について認識を高めていることも、医薬品安全性監視の取り組みの強化につながっています。さらに、有害事象の検出の効率と精度を向上させ、医薬品安全性監視に革命をもたらした人工知能やビッグデータ分析などの技術の進歩も、予測期間中の日本の市場を牽引すると予想されます。
日本の医薬品安全性監視市場のセグメント化:
IMARC Group は、2025年から2033年までの各国レベルの予測とともに、市場の各セグメントにおける主な傾向の分析を提供しています。当社のレポートでは、サービスプロバイダー、製品ライフサイクル、種類、プロセスフロー、治療分野、および最終用途に基づいて市場を分類しています。
サービスプロバイダーの洞察:
- 社内
- 契約アウトソーシング
このレポートでは、サービスプロバイダーに基づいて市場の詳細な内訳と分析を提供しています。これには、社内および契約アウトソーシングが含まれます。
製品ライフサイクルの洞察:
- 前臨床
- 第 I 相
- 第 II 相
- 第 III 相
- 第 IV 相
製品ライフサイクルに基づく市場の詳細な内訳と分析も、このレポートに記載されています。これには、前臨床、第 I 相、第 II 相、第 III 相、および第 IV 相が含まれます。
種類別洞察:
- 自発的報告
- 強化された ADR 報告
- 対象を絞った自発的報告
- コホートイベントモニタリング
- EHR マイニング
本レポートでは、種類別の市場の詳細な内訳と分析も提供しています。これには、自発的報告、強化された ADR 報告、対象を絞った自発的報告、コホートイベントモニタリング、EHR マイニングが含まれます。
プロセスフローの洞察:
- 症例データ管理
- 症例記録
- 症例データ分析
- 医療レビューおよび報告
- シグナル検出
- 有害事象の記録
- 有害事象の分析
- 有害事象のレビューおよび報告
- リスク管理システム
- リスク評価システム
- リスク軽減システム
また、プロセスフローに基づく市場の詳細な分析も報告書に記載されています。これには、症例データ管理(症例記録、症例データ分析、医療レビューおよび報告)、シグナル検出(有害事象の記録、有害事象の分析、有害事象のレビューおよび報告)、リスク管理システム(リスク評価システムおよびリスク軽減システム)が含まれます。
治療分野に関する洞察:
- 腫瘍内科
- 神経内科
- 循環器科
- 呼吸器系
- その他
本レポートでは、治療分野に基づく市場の詳細な分析と分類も提供しています。これには、腫瘍内科、神経内科、循環器科、呼吸器系などが含まれます。
最終用途に関する洞察:
- 製薬会社
- バイオテクノロジー企業
- 医療機器メーカー
- その他
本レポートでは、最終用途に基づく市場の詳細な分析も提供しています。これには、製薬会社、バイオテクノロジー企業、医療機器メーカーなどが含まれます。
競争環境:
この市場調査レポートでは、競争環境についても包括的な分析を行っています。市場構造、主要企業の位置付け、トップの戦略、競争ダッシュボード、企業評価の四分位分析などの競争分析もレポートで取り上げています。また、すべての主要企業の詳細なプロフィールも掲載しています。
1 はじめに
2 調査範囲および方法
2.1 調査の目的
2.2 ステークホルダー
2.3 データソース
2.3.1 一次情報源
2.3.2 二次情報源
2.4 市場予測
2.4.1 ボトムアップアプローチ
2.4.2 トップダウンアプローチ
2.5 予測方法
3 概要
4 日本の医薬品安全性監視市場 – 概要
4.1 概要
4.2 市場動向
4.3 業界動向
4.4 競合情報
5 日本の医薬品安全性監視市場の展望
5.1 過去の市場動向と現在の市場動向 (2019-2024)
5.2 市場予測(2025-2033
6 日本の医薬品安全性監視市場 – サービスプロバイダー別
6.1 社内
6.1.1 概要
6.1.2 過去の市場動向と現在の市場動向(2019-2024
6.1.3 市場予測 (2025-2033)
6.2 契約アウトソーシング
6.2.1 概要
6.2.2 過去の市場動向と現在の市場動向 (2019-2024)
6.2.3 市場予測 (2025-2033)
7 日本の医薬品安全性監視市場 – 製品ライフサイクル別内訳
7.1 前臨床
7.1.1 概要
7.1.2 過去の市場動向と現在の市場動向 (2019-2024)
7.1.3 市場予測 (2025-2033)
7.2 第 I 相
7.2.1 概要
7.2.2 過去および現在の市場動向(2019-2024
7.2.3 市場予測(2025-2033
7.3 第 II 相
7.3.1 概要
7.3.2 過去および現在の市場動向(2019-2024
7.3.3 市場予測(2025-2033
7.4 フェーズ III
7.4.1 概要
7.4.2 過去の市場動向と現在の市場動向(2019 年~2024 年
7.4.3 市場予測(2025 年~2033 年
7.5 フェーズ IV
7.5.1 概要
7.5.2 過去の市場動向と現在の市場動向(2019 年~2024 年
7.5.3 市場予測(2025-2033
8 日本の医薬品安全性監視市場 – 種類別
8.1 自発的報告
8.1.1 概要
8.1.2 過去の市場動向と現在の市場動向(2019-2024
8.1.3 市場予測(2025-2033
8.2 ADR 報告の強化
8.2.1 概要
8.2.2 過去の市場動向と現在の市場動向 (2019-2024)
8.2.3 市場予測 (2025-2033)
8.3 対象を絞った自発的報告
8.3.1 概要
8.3.2 過去の市場動向と現在の市場動向 (2019-2024)
8.3.3 市場予測 (2025-2033)
8.4 コホートイベントモニタリング
8.4.1 概要
8.4.2 過去の市場動向と現在の市場動向 (2019-2024)
8.4.3 市場予測 (2025-2033)
8.5 EHR マイニング
8.5.1 概要
8.5.2 過去の市場動向と現在の市場動向 (2019-2024)
8.5.3 市場予測 (2025-2033)
9 日本の医薬品安全性監視市場 – プロセスフロー別内訳
9.1 症例データ管理
9.1.1 概要
9.1.2 過去および現在の市場動向(2019-2024
9.1.3 市場セグメント
9.1.3.1 ケースの記録
9.1.3.2 ケースデータの分析
9.1.3.3 医学的レビューおよび報告
9.1.4 市場予測(2025-2033
9.2 シグナル検出
9.2.1 概要
9.2.2 過去の市場動向と現在の市場動向(2019年~2024年
9.2.3 市場区分
9.2.3.1 有害事象の記録
9.2.3.2 有害事象の分析
9.2.3.3 有害事象のレビューおよび報告
9.2.4 市場予測(2025年~2033年
9.3 リスク管理システム
9.3.1 概要
9.3.2 過去の市場動向と現在の市場動向(2019年~2024年
9.3.3 市場区分
9.3.3.1 リスク評価システム
9.3.3.2 リスク軽減システム
9.3.4 市場予測(2025年~2033年
10 日本の医薬品安全性監視市場 – 治療分野別内訳
10.1 腫瘍内科
10.1.1 概要
10.1.2 過去の市場動向と現在の市場動向(2019-2024)
10.1.3 市場予測(2025-2033)
10.2 神経内科
10.2.1 概要
10.2.2 過去および現在の市場動向(2019-2024
10.2.3 市場予測(2025-2033
10.3 循環器科
10.3.1 概要
10.3.2 過去および現在の市場動向(2019-2024
10.3.3 市場予測(2025-2033
10.4 呼吸器系
10.4.1 概要
10.4.2 過去の市場動向と現在の市場動向(2019-2024
10.4.3 市場予測(2025-2033
10.5 その他
10.5.1 過去および現在の市場動向(2019-2024
10.5.2 市場予測(2025-2033
11 日本の医薬品安全性監視市場 – 最終用途別内訳
11.1 製薬会社
11.1.1 概要
11.1.2 過去および現在の市場動向 (2019-2024)
11.1.3 市場予測 (2025-2033)
11.2 バイオテクノロジー企業
11.2.1 概要
11.2.2 市場動向(2019年~2024年)
11.2.3 市場予測(2025年~2033年
11.3 医療機器企業
11.3.1 概要
11.3.2 過去の市場動向および現在の市場動向 (2019-2024)
11.3.3 市場予測 (2025-2033)
11.4 その他
11.4.1 過去の市場動向および現在の市場動向 (2019-2024)
11.4.2 市場予測(2025-2033
12 日本の医薬品安全性監視市場 – 地域別内訳
12.1 関東地方
12.1.1 概要
12.1.2 過去の市場動向と現在の市場動向(2019-2024
12.1.3 サービスプロバイダー別市場
12.1.4 製品ライフサイクル別市場
12.1.5 種類別市場
12.1.6 プロセスフロー別市場
12.1.7 治療分野別市場
12.1.8 最終用途別市場
12.1.9 主要企業
12.1.10 市場予測(2025-2033
12.2 関西/近畿地域
12.2.1 概要
12.2.2 過去の市場動向と現在の市場動向(2019-2024
12.2.3 サービスプロバイダー別市場
12.2.4 製品ライフサイクル別市場
12.2.5 種類別市場
12.2.6 プロセスフロー別市場
12.2.7 治療分野別市場
12.2.8 最終用途別市場
12.2.9 主要企業
12.2.10 市場予測(2025-2033
12.3 中部・中部地方
12.3.1 概要
12.3.2 過去の市場動向と現在の市場動向(2019年~2024年
12.3.3 サービスプロバイダー別市場
12.3.4 製品ライフサイクル別市場
12.3.5 種類別市場
12.3.6 プロセスフロー別市場
12.3.7 治療分野別市場
12.3.8 最終用途別市場
12.3.9 主要企業
12.3.10 市場予測(2025-2033
12.4 九州・沖縄地域
12.4.1 概要
12.4.2 過去の市場動向と現在の市場動向(2019-2024
12.4.3 サービスプロバイダー別市場
12.4.4 製品ライフサイクル別市場
12.4.5 種類別市場
12.4.6 プロセスフロー別市場
12.4.7 治療分野別市場
12.4.8 最終用途別市場
12.4.9 主要企業
12.4.10 市場予測(2025-2033
12.5 東北地方
12.5.1 概要
12.5.2 過去の市場動向と現在の市場動向(2019-2024
12.5.3 サービスプロバイダー別の市場分析
12.5.4 製品ライフサイクル別の市場分析
12.5.5 種類別市場
12.5.6 プロセスフロー別市場
12.5.7 治療分野別市場
12.5.8 最終用途別市場
12.5.9 主要企業
12.5.10 市場予測(2025年~2033年
12.6 中国地方
12.6.1 概要
12.6.2 過去の市場動向と現在の市場動向(2019年~2024年
12.6.3 サービスプロバイダー別市場
12.6.4 製品ライフサイクル別市場
12.6.5 種類別市場
12.6.6 プロセスフロー別市場
12.6.7 治療分野別市場
12.6.8 最終用途別市場
12.6.9 主要企業
12.6.10 市場予測(2025-2033
12.7 北海道地域
12.7.1 概要
12.7.2 過去の市場動向と現在の市場動向(2019-2024
12.7.3 サービスプロバイダー別市場
12.7.4 製品ライフサイクル別市場内訳
12.7.5 種類別市場内訳
12.7.6 プロセスフロー別市場内訳
12.7.7 治療分野別市場内訳
12.7.8 最終用途別市場内訳
12.7.9 主要企業
12.7.10 市場予測(2025年~2033年
12.8 四国地方
12.8.1 概要
12.8.2 過去の市場動向と現在の市場動向(2019年~2024年
12.8.3 サービスプロバイダー別市場
12.8.4 製品ライフサイクル別市場
12.8.5 種類別市場
12.8.6 プロセスフロー別の市場区分
12.8.7 治療分野別の市場区分
12.8.8 最終用途別の市場区分
12.8.9 主要企業
12.8.10 市場予測(2025年~2033年
13 日本の医薬品安全性監視市場 – 競争環境
13.1 概要
13.2 市場構造
13.3 市場プレーヤーのポジショニング
13.4 トップの勝利戦略
13.5 競争ダッシュボード
13.6 企業評価クアドラント
14 主要プレーヤーのプロフィール
14.1 企業 A
14.1.1 事業概要
14.1.2 提供サービス
14.1.3 事業戦略
14.1.4 SWOT分析
14.1.5 主要なニュースとイベント
14.2 企業B
14.2.1 事業概要
14.2.2 提供サービス
14.2.3 事業戦略
14.2.4 SWOT分析
14.2.5 主要なニュースとイベント
14.3 企業C
14.3.1 事業概要
14.3.2 提供サービス
14.3.3 事業戦略
14.3.4 SWOT分析
14.3.5 主要なニュースとイベント
14.4 会社D
14.4.1 事業概要
14.4.2 提供サービス
14.4.3 事業戦略
14.4.4 SWOT分析
14.4.5 主要なニュースとイベント
14.5 会社E
14.5.1 事業概要
14.5.2 提供サービス
14.5.3 事業戦略
14.5.4 SWOT分析
14.5.5 主要なニュースとイベント
会社名はサンプル目次のため省略されています。詳細なリストは報告書に記載されています。
15 日本の医薬品安全性情報市場 – 業界分析
15.1 推進要因、抑制要因、および機会
15.1.1 概要
15.1.2 推進要因
15.1.3 抑制要因
15.1.4 機会
15.2 5つの競争力分析
15.2.1 概要
15.2.2 買い手の交渉力
15.2.3 供給者の交渉力
15.2.4 競争の度合い
15.2.5 新規参入の脅威
15.2.6 代替品の脅威
15.3 バリューチェーン分析
16 付録
*** 免責事項 ***
https://www.globalresearch.co.jp/disclaimer/