❖本調査資料に関するお問い合わせはこちら❖
Verified Market Researchによりますと、以下の推進要因とトレンドが市場を形成しております。
規制順守の強化 – 日本のPMDA(医薬品医療機器総合機構)は滅菌バリデーション要件を強化し、医薬品および医療機器分野全体における包括的なバイオバーデン試験の需要を促進しております。
高齢化に伴う医療のニーズ – 日本の急速な高齢化社会は医療機器や医薬品の需要を増加させており、製品安全性の確保に向けたバイオバーデン試験の要求水準向上と直接的に関連しています。
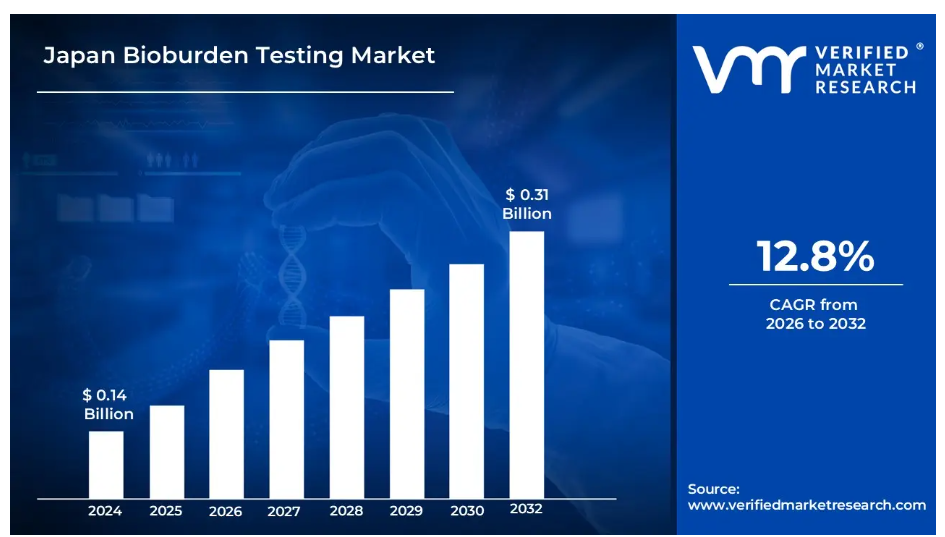
日本バイオバーデン試験市場レポート概要
- 2024年の市場規模: 1億4000万米ドル
- 2032年の市場規模: 3億1000万米ドル
- CAGR(2026年~2032年): 12.8%
- 主要セグメント:
- 試験別:好気性菌数試験が医薬品製造分野で最も高い採用率を占め主導的
- 最終用途別:製薬・バイオテクノロジー企業が最大のセグメントを占める
- 製品別:反復収益の性質から消耗品セグメントが主導
- 用途別:医療機器試験が最も強い成長軌道を示す
- 主要成長要因: 医薬品および医療機器の滅菌バリデーションに対する厳格な規制要件
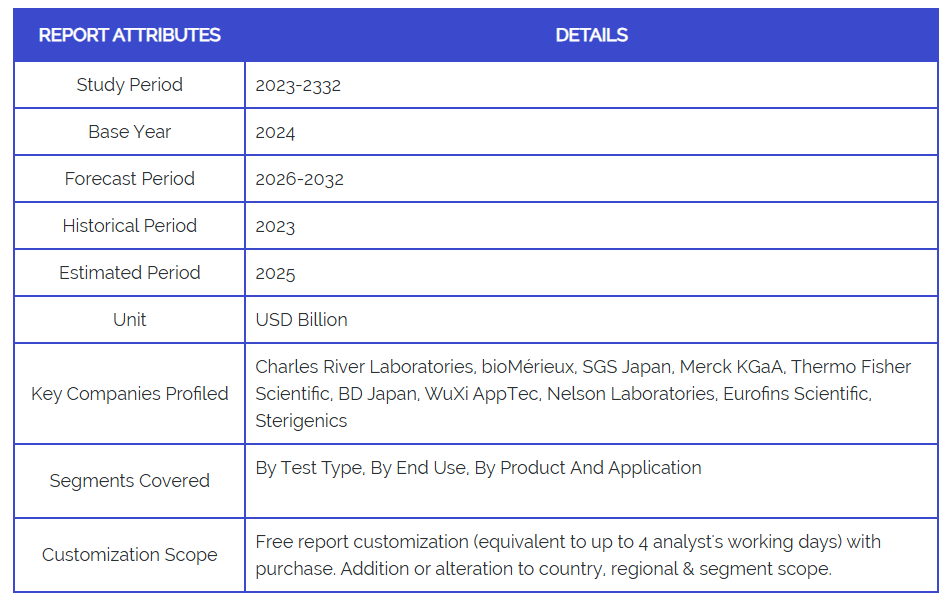
- 主要企業: Charles River Laboratories, bioMérieux, SGS Japan, Merck KGaA, Thermo Fisher Scientific, BD Japan, WuXi AppTec, Nelson Laboratories, Eurofins Scientific, Sterigenics
日本バイオバーデン試験市場の推進要因と動向
- 高度な製造自動化 – 日本の製造業者は、特に大量生産環境において、試験効率の向上と人的ミスの削減を図るため、自動微生物同定システムの導入を進めています。
- 受託製造の成長 – 医薬品・医療機器製造の専門施設へのアウトソーシング増加が、第三者によるバイオバーデン試験サービスおよび実験室機能の需要を牽引しています。
- 品質保証の統合 – 企業はバイオバーデン試験を包括的な品質管理システムに統合し、単なるコンプライアンス対応から、積極的な汚染防止戦略へと移行しています。
日本におけるバイオバーデン試験産業の制約と課題
- 初期投資コストの高さ – 先進的な自動試験装置には多額の資本投資が必要であり、中小メーカーの導入を制限し、市場参入障壁を生んでいます。
- 熟練人材の不足 – 日本では、高度なバイオバーデン試験手順を実施できる訓練を受けた微生物技術者や品質保証専門家の深刻な不足に直面しています。
- 試験期間の長期化 – 従来型の培養法では結果が出るまでに5~7日を要するため、ペースの速い製造環境ではボトルネックとなり、製品リリーススケジュールが遅延する可能性があります。
- 規制の複雑性 – PMDA(医薬品医療機器総合機構)、ISO規格、国際規制など、重複する要件を順守することは、複数の市場で事業を展開する企業にとってコンプライアンス上の課題となります。
- 技術統合の困難さ – 従来の製造システムは、最新の自動試験プラットフォームとの統合が困難な場合が多く、コストのかかるインフラのアップグレードや操業の中断を必要とします。
- 先進的な製造自動化 – 日本の製造業者は、特に大量生産環境において、試験効率の向上と人的ミスの削減を図るため、自動微生物同定システムの導入を進めています。
- 受託製造の成長 – 医薬品・医療機器製造の専門施設へのアウトソーシング増加が、第三者によるバイオバーデン試験サービス及び実験室機能への需要を牽引しています。
- 品質保証の統合 – 企業はバイオバーデン試験を包括的な品質管理システムに統合し、単なるコンプライアンス対応から、積極的な汚染防止戦略へと移行しています。
日本のバイオバーデン試験産業における制約と課題
- 初期投資コストの高さ – 先進的な自動試験装置には多額の資本投資が必要であり、中小メーカーの導入を制限し、市場参入障壁となっています。
- 熟練人材の不足 – 日本では、高度なバイオバーデン試験手順を実施できる訓練を受けた微生物検査技師や品質保証専門家の深刻な不足に直面しています。
- 試験期間の長期化 – 従来型の培養法では結果が出るまでに5~7日を要するため、ペースの速い製造環境ではボトルネックとなり、製品リリーススケジュールが遅延する可能性があります。
- 規制の複雑性 – PMDA(医薬品医療機器総合機構)、ISO規格、国際規制など、重複する要件を順守することは、複数の市場で事業を展開する企業にとってコンプライアンス上の課題となります。
- 技術統合の困難さ – 従来の製造システムは、最新の自動試験プラットフォームとの統合が困難な場合が多く、コストのかかるインフラのアップグレードや操業の中断を必要とします。
1. はじめに
• 市場定義
• 市場セグメンテーション
• 調査方法論
2. エグゼクティブサマリー
• 主な調査結果
• 市場概要
• 市場ハイライト
3. 市場概要
• 市場規模と成長可能性
• 市場動向
• 市場推進要因
• 市場制約要因
• 市場機会
• ポーターの5つの力分析
4. 日本バイオバーデン試験市場(試験種類別)
• 胞子数試験
• 真菌/カビ菌数試験
• 好気性菌数試験
• 嫌気性菌数試験
5. 日本バイオバーデン試験市場、用途別
• 医療機器メーカー
• 受託製造機関(CMO)
• 微生物試験研究所
• 食品・飲料および農産物メーカー
• 製薬・バイオテクノロジー企業
6. 日本バイオバーデン試験市場、製品別
• 分析装置
• 自動微生物同定システム
• PCR機器
• 消耗品
• 培地
• 試薬およびキット
7. 日本バイオバーデン試験市場、用途別
• 原材料試験
• 医療機器試験
• 工程内材料試験
• 滅菌バリデーション試験
• 設備洗浄バリデーション
8. 地域別分析
• 日本
9. 市場動向
• 市場推進要因
• 市場抑制要因
• 市場機会
• COVID-19が市場に与える影響
10. 競争環境
• 主要企業
• 市場シェア分析
11. 企業プロファイル
• Charles River Laboratories
• bioMérieux
• SGS Japan
• Merck KGaA
• Thermo Fisher Scientific
• BD Japan
• WuXi AppTec
• Nelson Laboratories
• Eurofins Scientific
• Sterigenics
12. 市場見通しと機会
• 新興技術
• 将来の市場動向
• 投資機会
13. 付録
• 略語一覧
• 出典と参考文献
❖本調査レポートの見積依頼/サンプル/購入/質問フォーム❖