❖本調査資料に関するお問い合わせはこちら❖
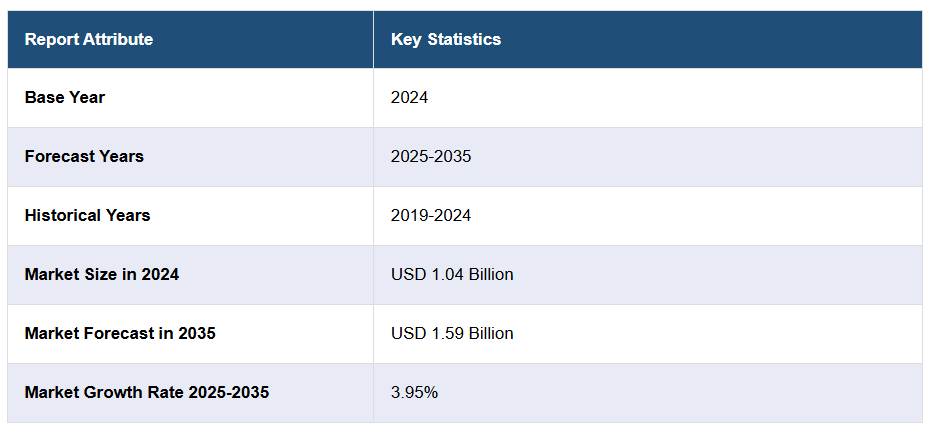
グリオーマ市場は、2024年に主要7市場(アメリカ、EU4、英国、日本)において10億4,000万ドルの規模に達しました。
今後の見通しとして、IMARC Groupは主要7市場が2035年までに15億9,000万ドルに達し、2025年から2035年にかけて年平均成長率(CAGR)3.95%の成長率を示すと予測しております。
IMARC社の新報告書「グリオーマ市場規模、疫学、市場内医薬品売上高、開発中の治療法、および地域別見通し 2025-2035年」において、グリオーマ市場が包括的に分析されております。グリオーマは、主に脳または脊髄のグリア細胞に発生する脳腫瘍の種類です。これらの細胞は、中枢神経系のニューロンに構造的完全性、栄養供給、保護を提供する上で身体にとって不可欠です。この疾患は悪性度や進行速度が様々です。一般的な症状としては、持続的な頭痛、発作、視覚の変化、言語理解・発話の困難、特定の身体部位の筋力低下や麻痺、認知機能や記憶の問題、性格の変化、平衡感覚や協調運動の障害などが挙げられます。腫瘍が脳のどの部位に影響を与えるかによって、他にも様々な疾患が現れる可能性があります。グリオーマの診断には、病歴評価、身体検査、および様々な診断検査の組み合わせが行われます。通常、症状と神経機能を評価するため、詳細な病歴聴取と神経学的検査から始まります。医療従事者はさらに、脳を可視化し腫瘍の存在を検出するため、陽電子放射断層撮影(PET)スキャン、X線、磁気共鳴画像法(MRI)などの画像検査を実施する場合があります。
グリア幹細胞または前駆細胞に突然変異DNAが蓄積し、制御不能な増殖を引き起こす遺伝性疾患の増加が、グリオーマ市場の主要な成長要因となっております。加えて、下流シグナル伝達分子の活性化を誘発し、細胞分裂の加速や腫瘍形成につながる電離放射線への曝露事例の増加も、市場にとって前向きな見通しを生み出しております。さらに、免疫チェックポイント阻害剤を用いた免疫療法の普及も市場成長を後押ししております。これは体内の防御システムを刺激し、異常細胞を認識・攻撃させるためです。これに加え、脳内に高精度な放射線照射を行う非侵襲的治療法である定位放射線手術の応用拡大も、患者の生存期間を大幅に延長する重要な成長要因となっております。加えて、腫瘍治療用電磁場療法(TTF療法)に対する需要の高まりも、今後数年間のグリオーマ市場を牽引すると予想されます。この療法は、他の従来療法と比較して全身性の副作用が最小限で、より耐容性が高く便利であるなど、数多くの利点があるためです。
IMARC Groupの新たなレポートは、米国、EU4(ドイツ、スペイン、イタリア、フランス)、英国、日本におけるグリオーマ市場について、包括的な分析を提供しています。これには、治療実践、市場流通中および開発中の薬剤、個別療法のシェア、7大市場における市場動向、主要企業とその薬剤の市場実績などが含まれます。本レポートではさらに、7大市場における現在および将来の患者層についても提示しています。レポートによれば、米国は神経膠腫の患者数が最も多く、その治療市場も最大規模を占めています。さらに、現在の治療実践/アルゴリズム、市場推進要因、課題、機会、償還シナリオ、未充足医療ニーズなども本報告書で提供されています。本報告書は、製造業者、投資家、ビジネス戦略家、研究者、コンサルタント、およびあらゆる形で膠芽腫市場に関与している、あるいは参入を計画している方々に必読の資料です。
最近の動向:
- 2025年3月、ラミナー・ファーマ社は、新規診断された膠芽腫治療薬LAM561を評価する進行中の臨床試験において、良好な結果を発表しました。
- 2025年2月、キメリックス社は、再発性H3K27M変異型びまん性膠芽腫患者向け治療薬ドルダビプロンの迅速承認を求める新薬承認申請(NDA)について、米国食品医薬品局(FDA)が受理したことを明らかにしました。本申請は優先審査が認められ、処方薬ユーザーフィー法(PDUFA)に基づく目標審査期限が2025年8月18日に設定されました。
- 2024年4月、デイワン・バイオファーマシューティカルズ社は、米国FDAがBRAF融合遺伝子または再編成、もしくはBRAF V600変異を有する再発性もしくは難治性の小児低悪性度膠芽腫患者(生後6ヶ月以上)に対する治療薬として、オジェンダ(トボラフェニブ)を承認したことを発表しました。
- 2023年3月、ノバルティスは米国FDAがタフィンラー(ダブラフェニブ)+メキニスト(トラメチニブ)の併用療法を、全身療法を必要とするBRAF V600E変異を有する1歳以上の小児低悪性度膠芽腫患者に対する治療として承認したと発表しました。FDAはタフィンラーおよびメキニストの液剤も承認し、BRAF/MEK阻害剤が1歳児に適した剤形で開発されたのは今回が初めてとなります。
主なポイント:
- 膠芽腫は最も頻度の高い原発性頭蓋内腫瘍であり、悪性脳腫瘍全体の81%を占めます。
- 世界では17番目に多い癌種であり、年間25万例以上の新規症例が確認されています。
- 男性は女性に比べ1.3倍グリオーマを発症しやすい傾向がありますが、女性でより多く見られるびまん性正中膠腫は例外です。
- ヨーロッパ、米国白人集団、イスラエルでは原発性悪性脳腫瘍の発生率が高いと報告されています。
- 拡散性星細胞腫などのグレード2膠芽腫の5年生存率は約40~50%です。
- グレード4膠芽腫(膠芽腫など)は最も悪性度が高く、5年生存率は約5~10%です。
薬剤:
GLIADEL Wafer(ポリフェプロサン20+カルムスチン製剤)は、手術および放射線治療に加えて、新たに高悪性度グリオーマと診断された患者様への使用が推奨されています。本療法は、個別包装された8枚のウエハーが入った単回投与用ボックスで提供されます。各ウエハーには7.7mgのカルムスチンが含まれており、2枚のアルミ箔ラミネート袋に包装されています。
LAM561は膠芽腫に対する新規経口薬であり、がん細胞膜の組成を変化させることで作用します。この変化により腫瘍増殖に不可欠なシグナル伝達経路が阻害され、がん細胞の増殖を効果的に停止させ、細胞死を誘導する可能性があります。LAM561はオレイン酸の合成誘導体であり、血液脳関門を通過できるため、脳内の腫瘍細胞を標的とすることが可能です。
キメリックス社のファースト・イン・クラスのイミプリドン系薬剤であるONC201は、ドーパミンD2/D3受容体を拮抗させ、ミトコンドリアプロテアーゼClpPを活性化することで膠芽腫を標的とします。これにより統合ストレス応答(ATF4/CHOPを介して)が誘発され、Akt/ERKシグナル伝達が阻害され、TRAIL/DR5が上調節され、ミトコンドリア呼吸が阻害され、腫瘍細胞のアポトーシスが誘導されます。
AB-218は、新規で強力かつ高選択性の変異型IDH-1阻害剤であり、血液脳関門透過性が高い特長を有します。神経膠腫患者を対象とした第I相試験において、有望な安全性および有効性の兆候が示されています。
調査期間
- 基準年:2024年
- 過去期間:2019年~2024年
- 市場予測:2025年~2035年
対象国
- アメリカ合衆国
- ドイツ
- フランス
- イギリス
- イタリア
- スペイン
- 日本
各国における分析内容
- 過去・現在・将来の疫学シナリオ
- 膠芽腫市場の過去・現在・将来の動向
- 市場における各種治療カテゴリーの過去・現在・将来の動向
- 膠芽腫市場における各種薬剤の売上高
- 市場における償還状況
- 市販薬および開発中の薬剤
競争環境:
本レポートでは、現在グリオーマ治療薬として販売されている薬剤および後期開発段階にあるパイプライン薬剤の詳細な分析も提供しております。
市販薬
- 薬剤概要
- 作用機序
- 規制状況
- 臨床試験結果
- 薬剤の採用状況と市場実績
後期開発段階パイプライン薬剤
- 薬剤概要
- 作用機序
- 規制状況
- 臨床試験結果
- 薬剤の採用状況と市場実績
本レポートで回答する主な質問:
市場インサイト
- グリオーマ市場はこれまでどのように推移し、今後数年間はどのように推移するでしょうか?
- 2024年における各種治療セグメントの市場シェアはどの程度であり、2035年までにはどのように推移する見込みでしょうか?
- 2024年における主要7市場の国別グリオーマ市場規模はどの程度であり、2035年にはどのような状況になるでしょうか?
- 7つの主要市場におけるグリオーマの成長率はどの程度でしょうか。また、今後10年間の予想成長率はどの程度でしょうか。
- 市場における主要な未充足ニーズは何でしょうか。
疫学に関する洞察
- 7つの主要市場におけるグリオーマの新規症例数(2019-2035年)はどの程度でしょうか。
- 7大市場における年齢層別のグリオーマ新規症例数(2019-2035年)はどの程度でしょうか?
- 7大市場における性別別のグリオーマ新規症例数(2019-2035年)はどの程度でしょうか?
- 7大市場における種類別のグリオーマ新規症例数(2019-2035年)はどの程度でしょうか?
- 主要7市場における膠芽腫の診断患者数は(2019-2035年)どの程度でしょうか?
- 主要7市場における膠芽腫患者プール規模は(2019-2024年)どの程度でしょうか?
- 主要7市場における膠芽腫患者プールの予測値(2025-2035年)はどの程度でしょうか?
- グリオーマの疫学的傾向を牽引する主な要因は何でしょうか?
- 7大市場における患者数の成長率はどの程度になるでしょうか?
グリオーマ:現在の治療状況、市販薬、および新興治療法
- 現在市販されている薬剤とその市場実績はどのようなものでしょうか?
- 主要なパイプライン薬剤は何か、また今後数年間でどのような実績が期待されるでしょうか?
- 現在市販されている薬剤の安全性および有効性はどの程度でしょうか?
- 後期開発段階のパイプライン薬剤の安全性および有効性はどの程度でしょうか?
- 主要7市場におけるグリオーマ治療薬の現行治療ガイドラインはどのようなものですか?
- 市場における主要企業はどの企業で、その市場シェアはどの程度でしょうか?
- 膠芽腫市場に関連する主要な合併・買収、ライセンス活動、提携などの動向はどのようなものでしょうか?
- 膠芽腫市場に関連する主要な規制関連の出来事はどのようなものでしょうか?
- 膠芽腫市場に関連する臨床試験の状況は、進捗状況別にどのような構造になっているでしょうか?
- 膠芽腫市場に関連する臨床試験の状況は、フェーズ別にどのような構造になっているでしょうか?
- 膠芽腫市場に関連する臨床試験の状況は、投与経路別にどのような構造になっているでしょうか?

1 前書き
2 調査範囲と方法論
2.1 調査目的
2.2 ステークホルダー
2.3 データソース
2.3.1 一次情報源
2.3.2 二次情報源
2.4 市場規模推定
2.4.1 ボトムアップアプローチ
2.4.2 トップダウンアプローチ
2.5 予測方法論
3 エグゼクティブサマリー
4 膠芽腫 – 概要
4.1 概要
4.2 規制プロセス
4.3 疫学(2019-2024年)および予測(2025-2035年)
4.4 市場概要(2019-2024年)および予測(2025-2035年)
4.5 競合情報
5 膠芽腫 – 疾患概要
5.1 はじめに
5.2 症状と診断
5.3 病態生理
5.4 原因とリスク要因
5.5 治療
6 患者の経過
7 膠芽腫 – 疫学および患者集団
7.1 疫学 – 主要な知見
7.2 疫学シナリオ – 主要7市場
7.2.1 疫学シナリオ(2019-2024年)
7.2.2 疫学予測(2025-2035年)
7.2.3 年齢別疫学(2019-2035年)
7.2.4 性別別疫学 (2019-2035)
7.2.5 種類別疫学 (2019-2035)
7.2.6 診断症例数 (2019-2035)
7.2.7 患者プール/治療症例数 (2019-2035)
7.3 疫学シナリオ – アメリカ合衆国
7.3.1 疫学シナリオ (2019-2024)
7.3.2 疫学予測 (2025-2035)
7.3.3 年齢別疫学 (2019-2035)
7.3.4 性別別の疫学 (2019-2035)
7.3.5 種類別の疫学 (2019-2035)
7.3.6 診断症例 (2019-2035)
7.3.7 患者プール/治療症例 (2019-2035)
7.4 疫学シナリオ – ドイツ
7.4.1 疫学シナリオ(2019-2024年)
7.4.2 疫学予測(2025-2035年)
7.4.3 年齢別疫学(2019-2035年)
7.4.4 性別別疫学(2019-2035年)
7.4.5 種類別疫学(2019-2035年)
7.4.6 診断症例数(2019-2035年)
7.4.7 患者プール/治療症例数(2019-2035年)
7.5 疫学シナリオ – フランス
7.5.1 疫学シナリオ(2019-2024年)
7.5.2 疫学予測(2025-2035年)
7.5.3 年齢別疫学(2019-2035年)
7.5.4 性別別疫学(2019-2035年)
7.5.5 種類別疫学(2019-2035年)
7.5.6 診断症例数(2019-2035年)
7.5.7 患者プール/治療症例数(2019-2035年)
7.6 イギリスにおける疫学シナリオ
7.6.1 イギリスにおける疫学シナリオ(2019-2024年)
7.6.2 イギリスにおける疫学予測(2025-2035年)
7.6.3 年齢別疫学(2019-2035年)
7.6.4 性別別疫学(2019-2035年)
7.6.5 種類別疫学(2019-2035年)
7.6.6 診断症例数(2019-2035年)
7.6.7 患者プール/治療症例(2019-2035年)
7.7 疫学シナリオ – イタリア
7.7.1 疫学シナリオ(2019-2024年)
7.7.2 疫学予測(2025-2035年)
7.7.3 年齢別疫学(2019-2035年)
7.7.4 性別別疫学(2019-2035年)
7.7.5 種類別疫学(2019-2035年)
7.7.6 診断症例(2019-2035年)
7.7.7 患者プール/治療症例(2019-2035年)
7.8 疫学シナリオ – スペイン
7.8.1 疫学シナリオ(2019-2024年)
7.8.2 疫学予測(2025-2035年)
7.8.3 年齢別疫学(2019-2035年)
7.8.4 性別別疫学(2019-2035年)
7.8.5 種類別疫学(2019-2035年)
7.8.6 診断症例数(2019-2035年)
7.8.7 患者プール/治療症例数(2019-2035年)
7.9 疫学シナリオ – 日本
7.9.1 疫学シナリオ(2019-2024年)
7.9.2 疫学予測(2025-2035年)
7.9.3 年齢別疫学(2019-2035年)
7.9.4 性別別疫学(2019-2035年)
7.9.5 種類別疫学(2019-2035年)
7.9.6 診断症例数(2019-2035年)
7.9.7 患者プール/治療症例数(2019-2035年)
8 膠芽腫 – 治療アルゴリズム、ガイドライン、医療実践
8.1 ガイドライン、管理および治療
8.2 治療アルゴリズム
9 膠芽腫 – 未充足医療ニーズ
10 膠芽腫 – 治療の主要エンドポイント
11 膠芽腫 – 市販製品
11.1 主要7市場における膠芽腫治療薬リスト
11.1.1 グリエードル・ウェーファー(カルムスチン・ポリフェプロサン20ウェーファー) – アーバー・ファーマシューティカルズ
11.1.1.1 薬剤概要
11.1.1.2 作用機序
11.1.1.3 規制状況
11.1.1.4 臨床試験結果
11.1.1.5 主要市場における売上高
11.1.2 アバスチン(ベバシズマブ) – ジェネンテック/ロシュ
11.1.2.1 薬剤概要
11.1.2.2 作用機序
11.1.2.3 規制状況
11.1.2.4 臨床試験結果
11.1.2.5 主要市場における売上高
11.1.3 テモダール(テモゾロミド) – メルク社
11.1.3.1 薬剤概要
11.1.3.2 作用機序
11.1.3.3 規制状況
11.1.3.4 臨床試験結果
11.1.3.5 主要市場における売上高
11.1.4 タフィンラー(ダブラフェニブ) – ノバルティス
11.1.4.1 薬剤概要
11.1.4.2 作用機序
11.1.4.3 規制状況
11.1.4.4 臨床試験結果
11.1.4.5 主要市場における売上高
11.1.5 メキニスト(トラメチニブ) – ノバルティス
11.1.5.1 薬剤概要
11.1.5.2 作用機序
11.1.5.3 規制状況
11.1.5.4 臨床試験結果
11.1.5.5 主要市場における売上高
11.1.6 オジェムダ(トボラフェニブ) – デイワン・バイオファーマシューティカルズ
11.1.6.1 薬剤概要
11.1.6.2 作用機序
11.1.6.3 規制状況
11.1.6.4 臨床試験結果
11.1.6.5 主要市場における売上高
上記は市販薬の一部リストに過ぎませんので、ご了承ください。完全なリストは本報告書に記載されております。
12 膠芽腫 – 開発中の薬剤
12.1 主要7市場における膠芽腫開発中薬剤リスト
12.1.1 LAM561 – ラミナール・ファーマシューティカルズ
12.1.1.1 薬剤概要
12.1.1.2 作用機序
12.1.1.3 臨床試験結果
12.1.1.4 安全性および有効性
12.1.1.5 規制状況
12.1.2 AB-218 – AnHeart Therapeutics
12.1.2.1 薬剤概要
12.1.2.2 作用機序
12.1.2.3 臨床試験結果
12.1.2.4 安全性および有効性
12.1.2.5 規制状況
12.1.3 ONC201 – Chimerix
12.1.3.1 薬剤概要
12.1.3.2 作用機序
12.1.3.3 臨床試験結果
12.1.3.4 安全性および有効性
12.1.3.5 規制状況
上記は開発中の薬剤の一部リストに過ぎませんので、ご了承ください。完全なリストは本報告書に記載されております。
13. 膠芽腫 – 主要市販薬および開発中薬剤の属性分析
14. 膠芽腫 – 臨床試験の状況
14.1 ステータス別薬剤
14.2 フェーズ別薬剤
14.3 投与経路別医薬品
14.4 主要な規制関連イベント
15 膠芽腫 – 市場シナリオ
15.1 市場シナリオ – 主要な知見
15.2 市場シナリオ – トップ7市場
15.2.1 膠芽腫 – 市場規模
15.2.1.1 市場規模(2019-2024年)
15.2.1.2 市場予測(2025-2035年)
15.2.2 グリオーマ – 治療法別市場規模
15.2.2.1 治療法別市場規模(2019-2024年)
15.2.2.2 治療法別市場予測(2025-2035年)
15.3 市場シナリオ – 米国
15.3.1 膠芽腫 – 市場規模
15.3.1.1 市場規模(2019-2024年)
15.3.1.2 市場予測(2025-2035年)
15.3.2 膠芽腫 – 治療法別市場規模
15.3.2.1 治療法別市場規模(2019-2024年)
15.3.2.2 治療法別市場予測(2025-2035年)
15.3.3 神経膠腫 – アクセスおよび償還の概要
15.4 市場シナリオ – ドイツ
15.4.1 神経膠腫 – 市場規模
15.4.1.1 市場規模(2019-2024年)
15.4.1.2 市場予測(2025-2035年)
15.4.2 神経膠腫 – 治療法別市場規模
15.4.2.1 治療法別市場規模(2019-2024年)
15.4.2.2 治療法別市場予測(2025-2035)
15.4.3 神経膠腫 – アクセスおよび償還の概要
15.5 市場シナリオ – フランス
15.5.1 神経膠腫 – 市場規模
15.5.1.1 市場規模(2019-2024)
15.5.1.2 市場予測(2025-2035年)
15.5.2 グリオーマ – 治療法別市場規模
15.5.2.1 治療法別市場規模(2019-2024年)
15.5.2.2 治療法別市場予測(2025-2035年)
15.5.3 グリオーマ – アクセスおよび償還の概要
15.6 市場シナリオ – イギリス
15.6.1 グリオーマ – 市場規模
15.6.1.1 市場規模(2019-2024)
15.6.1.2 市場予測(2025-2035)
15.6.2 神経膠腫 – 治療法別市場規模
15.6.2.1 治療法別市場規模(2019-2024年)
15.6.2.2 治療法別市場予測(2025-2035年)
15.6.3 神経膠腫 – アクセスおよび償還の概要
15.7 市場シナリオ – イタリア
15.7.1 神経膠腫 – 市場規模
15.7.1.1 市場規模(2019-2024年)
15.7.1.2 市場予測(2025-2035年)
15.7.2 神経膠腫 – 治療法別市場規模
15.7.2.1 治療法別市場規模(2019-2024年)
15.7.2.2 治療法別市場予測(2025-2035年)
15.7.3 神経膠腫 – アクセスおよび償還の概要
15.8 市場シナリオ – スペイン
15.8.1 神経膠腫 – 市場規模
15.8.1.1 市場規模(2019-2024年)
15.8.1.2 市場予測(2025-2035年)
15.8.2 グリオーマ – 治療法別市場規模
15.8.2.1 治療法別市場規模(2019-2024年)
15.8.2.2 治療法別市場予測(2025-2035)
15.8.3 神経膠腫 – アクセスおよび償還の概要
15.9 市場シナリオ – 日本
15.9.1 神経膠腫 – 市場規模
15.9.1.1 市場規模(2019-2024)
15.9.1.2 市場予測(2025-2035年)
15.9.2 膠芽腫 – 治療法別市場規模
15.9.2.1 治療法別市場規模(2019-2024年)
15.9.2.2 治療法別市場予測(2025-2035年)
15.9.3 グリオーマ – アクセスと償還の概要
16 グリオーマ – 最近の動向と主要オピニオンリーダーからの意見
17 グリオーマ市場 – SWOT分析
17.1 強み
17.2 弱み
17.3 機会
17.4 脅威
18 グリオーマ市場 – 戦略的提言
19 付録
❖本調査レポートの見積依頼/サンプル/購入/質問フォーム❖